化学平衡:如何区分产率与转化率的本质差异?
在化学领域,尤其是化学反应的研究中,产率和转化率是两个至关重要的概念,它们不仅关乎着化学反应的效率,也是评估反应成功与否的关键指标。然而,尽管这两个概念在化学平衡的讨论中频繁出现,许多初学者往往难以准确区分它们的含义及其在应用上的区别。本文旨在深入探讨化学平衡中产率和转化率的区别,以期帮助读者更好地理解和应用这两个概念。
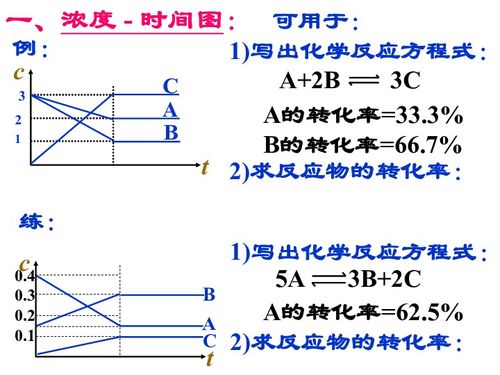
首先,我们需要明确什么是化学平衡。化学平衡是指在一定条件下,可逆反应的正反应和逆反应速率相等,反应物和生成物的浓度保持不变的状态。在这种状态下,反应并未停止,而是达到了一个动态平衡,即反应物和生成物之间在不断地相互转化,但宏观上看起来浓度保持不变。

接下来,我们逐一分析产率和转化率的定义及其计算方式。产率是指化学反应中实际生成的产物质量与理论生成产物质量的比值,通常以百分数表示。它反映了化学反应的效率,即反应物转化为目标产物的能力。产率的计算公式为:产率=(实际生成产物的质量/理论生成产物的质量)×100%。在理想情况下,如果反应完全进行,且没有副反应发生,那么产率应该接近100%。然而,在实际操作中,由于各种原因(如反应条件、反应物的纯度、副反应等),产率往往低于理论值。
转化率则是指化学反应中某一反应物被消耗的比例,即已反应的反应物质量与原反应物质量的比值,同样以百分数表示。它反映了反应物在化学反应中的利用程度。转化率的计算公式为:转化率=(已反应的反应物质量/原反应物质量)×100%。需要注意的是,转化率是针对某一特定反应物而言的,不同的反应物在同一反应中可能有不同的转化率。
从定义上看,产率和转化率分别描述了化学反应的两个不同方面:产率关注的是产物生成的效率,而转化率则关注的是反应物的利用程度。因此,在化学平衡的讨论中,这两个概念具有不同的侧重点和应用场景。
在化学平衡状态下,产率和转化率的关系并不是简单的正比或反比关系。由于化学平衡的存在,反应物和生成物的浓度保持相对稳定,这意味着即使反应继续进行,产物的生成速率和反应物的消耗速率也将保持恒定。因此,产率和转化率在化学平衡状态下将趋于稳定值,这些值取决于反应的条件、反应物的性质以及反应机理等多种因素。
为了更直观地理解产率和转化率的区别,我们可以通过一个具体的化学反应来进行说明。假设我们有一个简单的合成反应,A和B反应生成C。在这个反应中,我们可以通过控制反应条件(如温度、压力、催化剂等)来影响反应的进程和平衡状态。当我们改变这些条件时,反应物和生成物的浓度将发生变化,从而影响到产率和转化率。
例如,在反应初期,由于反应物浓度较高,反应速率较快,转化率迅速上升。随着反应的进行,反应物浓度逐渐降低,反应速率减慢,转化率增长趋势放缓。当反应达到平衡状态时,转化率将达到一个最大值(在理想情况下可能接近100%,但在实际操作中往往低于这个值)。同时,产率也将达到一个稳定值,这个值取决于反应条件、反应物的纯度以及副反应等因素。
值得注意的是,即使反应达到平衡状态,产率和转化率也可能存在较大的差异。这是因为产率不仅取决于反应物的转化率,还受到副反应、产物纯度等因素的影响。例如,在某些情况下,即使反应物的转化率很高,但由于副反应的存在导致目标产物纯度降低,产率也可能较低。反之,如果反应条件优化得当,副反应得到有效抑制,即使反应物的转化率不是最高,产率也可能达到较高的水平。
此外,还需要注意的是,在化学平衡的讨论中,我们不能简单地将产率和转化率视为衡量化学反应成功与否的唯一标准。实际上,化学反应的成功与否还取决于多种因素的综合考虑,如反应的选择性(即目标产物与副产物的比例)、反应的安全性(如是否产生有毒有害物质)、反应的经济性(如原料成本、能源消耗等)等。
综上所述,化学平衡中的产率和转化率是两个具有不同侧重点和应用场景的概念。产率关注产物生成的效率和质量,而转化率则关注反应物的利用程度。在化学平衡状态下,这两个指标将趋于稳定值,并受到多种因素的影响。因此,在研究和优化化学反应时,我们需要综合考虑产率和转化率等多个方面的指标,以期实现更高效、更安全的化学反应过程。同时,我们也需要不断学习和探索新的化学反应技术和方法,以应对日益增长的化学工业需求和环境保护挑战。
- 上一篇: 揭秘!诺亚方舟究竟是不是成语?
- 下一篇: Word中高效利用格式刷的技巧
新锐游戏抢先玩
游戏攻略帮助你
更多+-
02/20
-
02/20
-
02/20
-
02/20
-
02/20









